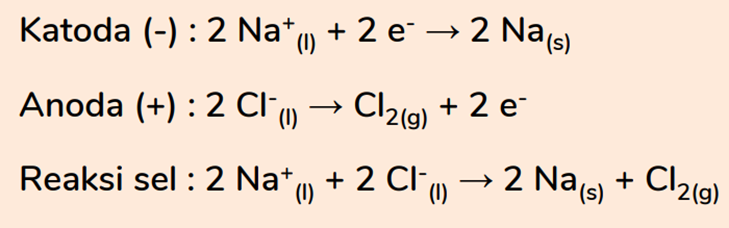Natrium adalah suatu unsur kimia dalam tabel periodic yang memiliki lambang Na dan nomor atom 11. Natrium adalah unsur keenam paling melimpah dalam kerak bumi, dan terdapat di banyak mineral seperti feldspar, sodalit dan halit (garam batu, NaCl). Banyak garam natrium sangat larut dalam air: ion natrium telah dilindi oleh aksi air dari mineral Bumi selama ribuan tahun, dan dengan demikian natrium dan klorin adalah unsur terlarut yang paling umum terjadi di lautan (berdasarkan berat).
Natrium pertama kali diisolasi oleh Humphry Davy pada tahun 1807 melalui elektrolisis natrium hidroksida. Di antara banyak senyawa natrium lain yang berguna, natrium hidroksida (lindi, bahasa Inggris: lye) digunakan dalam pembuatan sabun, dan natrium klorida (garam dapur) adalah zat pencair es [en] dan nutrisi untuk hewan termasuk manusia.
KETERSEDIAAN DI ALAM
SIFAT NATRIUM
- Logam reaktif yang lunak, keperakan, dan seperti lilin,
- Termasuk ke logam alkali yang banyak terdapat dalam senyawa alam (terutama halite).
- Nyala apinya berwarna kuning,
- Beroksidasi dalam udara,
- Bereaksi kuat dengan air, sehingga harus disimpan dalam minyak.
- Karena sangat reaktif, natrium hampir tidak pernah ditemukan dalam bentuk unsur murni.
- Natrium mengapung di air,
- Menguraikannya menjadi gas hidrogen dan ion hidroksida.
- Jika digerus menjadi bubuk, natrium akan meledak dalam air secara spontan.
- Natrium juga bila dalam keadaan berikatan dengan ion OH- maka akan membentuk basa kuat yaitu NaOH.
SIFAT FISIKA NATRIUM
- Fase padat
- Titik lebur 370,87 K (97,72 °C, 207,9 °F)
- Titik didih 1156 K (883 °C, 1621 °F) Kepadatan mendekati s.k. 0,968 g/cm3saat cair, pada t.l.
- 0,927 g/cm3
- Titik kritis (ekstrapolasi) 2573 K, 35 MPa
- Kalor peleburan 2,60 kJ/mol
- Kalor penguapan 97,42 kJ/mol
- Kapasitas kalor molar 28,230 J/(mol·K)
REAKSI UNSUR NATRIUM
KEGUNAAN NATRIUM
- Natrium tiosulfat (Na2S2O3 ), larutan pencuci (hipo) dalam fotografi.
- Na3AlF6 , pelarut dalam sintesis logam alumunium.
- Natrium sulfat dekahidrat (Na2SO4 .10H2O) atau garam glauber : digunakan oleh industri pembuat kaca.
- Na3Pb8 : sebagai pengisi lampu Natrium.
- Natrium peroksida (Na2O2 ): pemutih makanan.
- Na-benzoat, zat pengawet makanan dalam kaleng, obat rematik.
- Na-glutamat, penyedap masakan (vetsin).
- Na-salsilat, obat antipiretik (penurun panas